レジメンの切り替えおよび簡素化の管理 MANAGING REGIMEN SWITCH &
SIMPLIFICATION
治療の簡素化または切り替えを希望する患者の管理
ウイルス学的抑制が得られている患者に対する治療の切り替えまたは簡素化の理由
ARTの切り替えや簡素化の理由には、先手を打った対策と後回しの対応がみられる。1日1回1錠レジメンが使用可能になる前は、毒性や有害事象を軽減するために治療を切り替える患者が多かった。しかし、最近は、簡素化するために切り替える患者が増えている。
スペインで実施された研究では、切り替えの主な理由は、簡素化(40.2%)、毒性(29.2%)、免疫学的/ウイルス学的失敗(20.1%)であった。2011年に実施されたこの研究の主な知見は、その時期の患者は、有効性の低いレジメンから強力で服用しやすいレジメンに変更していたことである。
米国のクリニックのHIV-1感染患者263例を対象とした研究では、患者に「現在、服用している抗HIV薬と比較して、以下の新しい治療法:a) 1ヵ月に1回1錠服用する、b) 2ヵ月に1回クリニックで2回注射を受ける、c) 6ヵ月に1回、前腕に小さなプラスチック製のインプラントを2つ埋め込む、に切り替えることにどの程度関心があるかを質問した。患者の66%は週1回1錠服用する治療法への切り替えに、38%は2ヵ月に1回クリニックで注射を2回受けることに非常に関心があり、6ヵ月に1回前腕への小さなプラスチック製のインプラント2つの埋め込みに非常に関心があったのはわずか18%であった。
HBV:B型肝炎ウイルス、HCV:C型肝炎ウイルス、OI:日和見感染症
ウイルス学的抑制が得られている患者に対する切り替え戦略に関する原則
DHHSおよびEACSのガイドラインには、ウイルス学的抑制が得られている患者のARVレジメンの構成要素を切り替える場合に考慮すべきいくつかの原則が示されている。
この場合、新しいレジメン構築の際の目標は、将来の治療選択肢を脅かすことなくウイルス学的抑制を維持することである。
臨床医は、ウイルス学的反応、耐性検査結果とこれまでのレジメンでみられたあらゆる忍容性、毒性、有害反応など、患者のすべての治療歴を注意深くレビューしなければならない。また、複雑な症例については、薬剤耐性HIVの専門家に相談することを検討する。
新しい薬剤の選択の際は、新しいARVと患者が服用しているあらゆる併用薬との薬物相互作用の可能性も評価する必要がある。また、新しいARVの選択に影響を及ぼす可能性があるため、臨床医は、HBV重感染、妊娠、または妊娠の予定についても考慮しなければならない。TDFまたはTAFの中止により、HBVの再活性化が生じる可能性があることに留意する。
臨床医は、レジメンを変更してから最初の3ヵ月間は、フォローアップの電話や4週目のウイルス量の評価など、患者を注意深くモニタリングしなければならない。
ARV:抗HIV薬、HBV:B型肝炎ウイルス、TAF:テノホビルアラフェナミドフマル酸塩、TDF:テノホビルジソプロキシルフマル酸塩
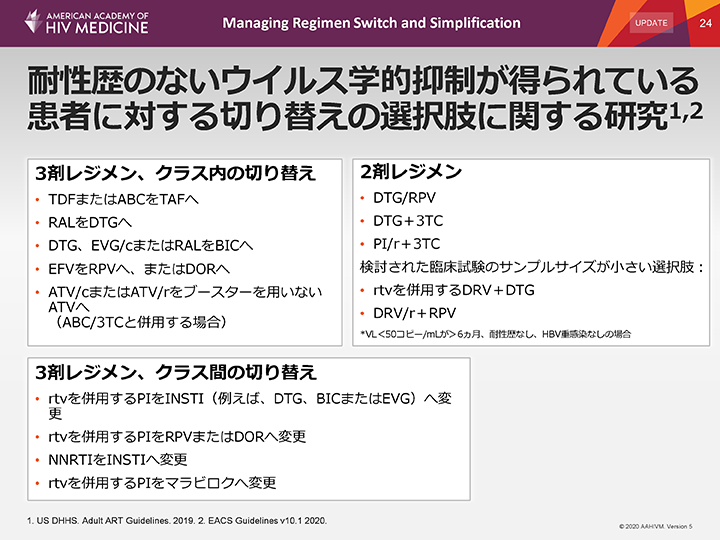
耐性歴のないウイルス学的抑制が得られている患者に対する切り替えの選択肢に関する研究
DHHSおよびEACSのガイドラインは、ウイルス量が抑制されている患者のレジメンを切り替える場合、一般的に2剤または3剤併用レジメンを推奨している。
このスライドに記載した切り替えの選択肢の例は、薬剤耐性HIVに感染していない患者を対象に研究され、一般的に、前のレジメンに対する非劣性が示され、一部では優越性が示されている。
新しいARVに対する耐性歴の有無を確認するため、耐性検査結果を参考にする必要がある。薬剤耐性歴が不明の場合や、新しいレジメンの薬剤の活性について疑問がある場合は、切り替えを避けるべきである。
3剤レジメンで治療を開始しウイルス学的抑制を達成した患者において、一部の2剤レジメンはウイルス学的抑制の維持に有効であることが示されており、DHHSとEACSのガイドラインは、いくつかの2剤レジメンへの切り替えの選択肢を推奨している。これらの推奨は、両剤が活性を有し、慢性HBV重感染がない患者を前提としている。推奨されている2剤レジメンはいずれも十分な抗HBV活性を有しておらず、HBV重感染者には推奨されない。
次では、これらの切り替えに関する臨床試験データの一部をレビューする。
3TC:ラミブジン、ABC:アバカビル、ATV:アタザナビル、BIC:ビクテグラビル、c:コビシスタット、DOR:ドラビリン、DRV:ダルナビル、DTG:ドルテグラビル、EFV:エファビレンツ、EVG:エルビテグラビル、HBV:B型肝炎ウイルス、PI/r:rtv(リトナビル)を併用するプロテアーゼ阻害剤、rtv:リトナビル、RAL:ラルテグラビル、RPV:リルピビリン、TAF:テノホビルアラフェナミドフマル酸塩、TDF:テノホビルジソプロキシルフマル酸塩、VL:ウイルス量
ウイルス学的抑制が得られている患者におけるテノホビルアラフェナミドフマル酸塩(TAF)への切り替えに関する試験の要約
このスライドでは、テノホビルアラフェナミドフマル酸塩(TAF)への切り替えに関するさまざまな試験の要約を記載している。これらの試験は、さまざまな患者集団を対象とし、さまざまな切り替え戦略を検討しており、主に非劣性を主要評価項目としている。いくつかの試験では優越性が示されている。例えば、GS-109試験では、エファビレンツベースまたはリトナビルを併用するアタザナビルベースのレジメンで治療を開始した患者がE/C/F/TAFに切り替えた場合、優越性が示された。GS-119試験でも優越性が示された。
いくつかの試験で観察された骨密度の増加は、テノホビルジソプロキシルフマル酸塩(TDF)からTAFへの切り替えによる骨密度の回復を反映したものと考えられる。一部の試験では推算糸球体濾過率(eGFR)の安定性も認められた。eGFRの改善が認められた試験もあり、尿細管毒性は認められず、タンパク尿の各指標の改善が認められた。
骨折や慢性腎疾患の発生率の減少については、これらの試験では実際の臨床アウトカムがまだ示されていないため報告されていない。
ウイルス学的抑制が得られているHIV感染患者を対象に、TDFからTAFへの切り替え時(他のすべてのARVは継続するかINSTIに切り替えた)の体重変化を評価した縦断的コホート研究では、TAFに切り替え後の最初の9ヵ月間に顕著な体重増加が認められた(すべてのレジメンで1.80~4.47 kg/年) 。切り替え後9ヵ月以降の体重増加は横ばいとなった。これらの結果より、TAFは体重に対し独立して影響を及ぼすと考えられる。
ART:抗レトロウイルス療法、ATV:アタザナビル、CKD:慢性腎疾患、c:コビシスタット、DRV:ダルナビル、EFV:エファビレンツ、eGFR:推算糸球体濾過率、EVG:エルビテグラビル、FTC:エムトリシタビン、RPV:リルピビリン、rtv (or) r:リトナビル、TAF:テノホビルアラフェナミドフマル酸塩、TDF:テノホビルジソプロキシルフマル酸塩
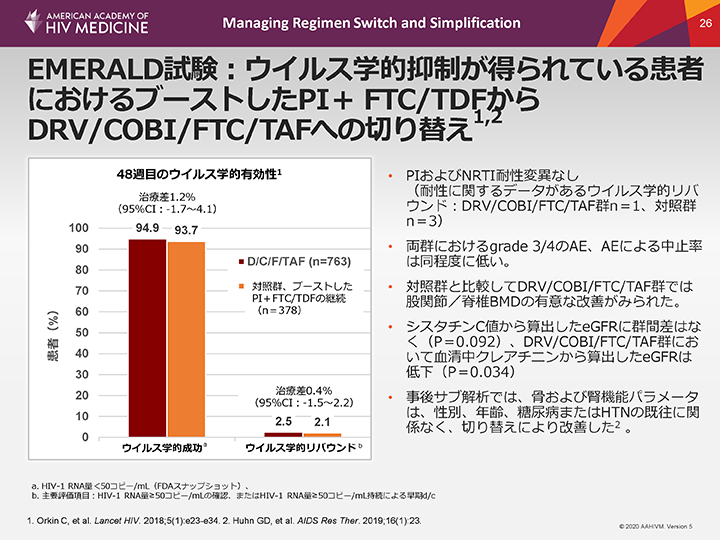
EMERALD試験:ウイルス学的抑制が得られている患者におけるブーストしたPI+ FTC/TDFからDRV/COBI/FTC/TAFへの切り替え
EMERALD試験には、米国、英国および欧州の患者1,141例が組み入れられた。80%超が男性であり、年齢の中央値は46歳であった。HIV感染期間の中央値は9年であり、約60%がこれまでに5つ以上の抗HIV薬を使用していた。ベースライン時に、ウイルス量50コピー/mL未満を2ヵ月以上維持していた。CD4+細胞数の中央値は高く、約630細胞/mm3であった。切り替え時の腎機能は正常であった。
ほとんどの患者(約70%)は、多剤レジメンにおいてブーストしたダルナビル(DまたはDRV)をすでに使用しており、22%がブーストしたアタザナビル(ATV)、8%がロピナビル(LPV)/リトナビル(rtv)を使用していた。約15%はすでにコビシスタット(CまたはCOBI)を使用しており、残りはブースターとしてrtvを使用していた。15%にウイルス学的失敗歴があったが、DRVによる治療失敗歴やDRV耐性関連変異のエビデンスがある患者は除外された。
この非盲検試験に組み入れられた患者を、D/C/F/TAFの1日1回1錠レジメン切り替え群と、現在の併用レジメンの48週間継続群に無作為に割り付けた。48週目には、D/C/F/TAF切り替え群の94.9%、ベースラインの併用レジメン継続群の93.7%が、検出限界値未満のウイルス量を維持していた。両群における奏効率は統計学的に同程度であり、D/C/F/TAFは多剤併用レジメンに対して非劣性であることが示された。ウイルス学的失敗歴およびこれまでの複数のARV使用歴の有無にかかわらず、結果には一貫性があった。ITT解析によると、96週目には、即時切り替え群で投与を継続した患者の91%(694/763例)がウイルス学的抑制を維持していた。48週目から96週目までに、試験実施計画書で規定したウイルス学的リバウンド(ウイルス量50コピー/mL以上)が24例(3.1%)に認められた。このうちの14例は、ウイルス量が再抑制された。4例(0.5%)はウイルス量が200コピー/mL以上となり、2例は再抑制された。ベースライン後に、DRV、TDFおよびFTCに対する耐性関連変異(RAM)、またPIに対して一次耐性につながるRAMは認められなかった。
両群ともにウイルス学的リバウンドがみられた患者は少なく、D/C/F/TAF群2.5%、ベースラインレジメン群2.1%であった。リバウンドがみられた患者の大半は、治療を変更することなく、48週目までにウイルス血症の再抑制を達成することができた。ウイルス学的失敗率も低く同程度であり(それぞれ0.8%と0.5%)、ウイルス学的失敗により治療を中止した患者はいなかった。ジェノタイプ薬剤耐性検査を受けた患者では、いずれの治験薬に対しても耐性につながる突然変異は認められなかった。
年齢(50歳以下/超)、性別、人種(黒人/非黒人)、これまでに使用した抗HIV薬数(4/5/6/7/7超)、VF歴(0/1以上)、ベースラインのブーストしたPI(ダルナビル/アタザナビルまたはロピナビル)およびベースラインのブースター剤(rtv/COBI)に基づいてサブグループ解析を行ったところ、いずれの人口統計学的特性に基づくサブグループにおいてもウイルス学的リバウンド率、ウイルス学的奏効率、有害事象発現率は同程度であり、腎機能および骨パラメータはD/C/F/TAF群で改善がみられた。
治療は概ね安全で忍容性も良好であった。重篤な有害事象(D/C/F/TAF群4.6%、ベースラインレジメン群4.8%)や有害事象による中止(それぞれ1.4%と1.3%)は少なかった。最もよくみられた有害事象は、上咽頭炎(鼻と喉の炎症)、上気道感染および下痢であった。
D/C/F/TAF群は、TDFを含むレジメン継続群よりも全体的に腎機能および骨代謝のバイオマーカーの数値が良好であり、TAFの新規プロドラッグが腎臓や骨に及ぼす影響が少ないことが確認された。
一般的な腎機能の指標である推算糸球体濾過率(eGFR)は、D/C/F/TAF群でやや低下したが、これはコビシスタットの腎尿細管からのクレアチニン分泌への阻害作用に起因すると考えられた。しかし、別の方法を用いてeGFRを測定した場合、D/C/F/TAF群ではeGFRが概ね安定していることが示された。股関節および脊椎の骨密度は、D/C/F/TAF群ではわずかに増加したが、ベースラインレジメン群ではわずかに低下した。血中脂質プロファイルは、D/C/F/TAF群でやや不良であった。
AE:有害事象、BMD:骨密度、CI:信頼区間、CまたはCOBI:コビシスタット、d/c:中止、DまたはDRV:ダルナビル、eGFR:推算糸球体濾過率、FまたはFTC:エムトリシタビン、HTN:高血圧、TAF:テノホビルアラフェナミドフマル酸塩、TDF:テノホビルジソプロキシルフマル酸塩
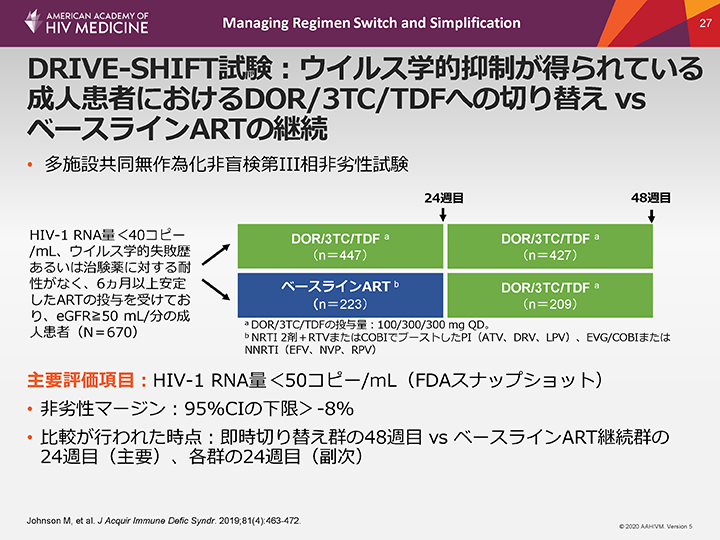
DRIVE-SHIFT試験:ウイルス学的抑制が得られている成人患者におけるDOR/3TC/TDFへの切り替え vs ベースラインARTの継続
安定したウイルス学的抑制が得られている患者のレジメンを、ドラビリン、3TCおよびテノホビルに切り替えた場合とベースラインARTを継続した場合の有効性と安全性を比較評価するためにDRIVE-SHIFT試験が実施された。
ウイルス学的抑制が6ヵ月以上得られており、ウイルス学的失敗歴や治験薬に対する耐性がなく、eGFRが50 mL/分以上の成人患者を適格として試験に組み入れた。主要評価項目は、FDAのスナップショット解析によるHIV-1 RNA量とし、50コピー/mL未満をカットオフ値とした。評価時点については、即時切り替え群の48週目とベースラインART継続群の24週目の結果、各群の24週目の結果(副次解析として)を比較した。
3TC:ラミブジン、ART:抗レトロウイルス療法、ATV:アタザナビル、CI:信頼区間、COBI:コビシスタット、DOR:ドラビリン、DRV:ダルナビル、EFV:エファビレンツ、eGFR:推算糸球体濾過率、EVG:エルビテグラビル、LPV:ロピナビル、NVP:ネビラピン、QD:1日1回、RPV:リルピビリン、RTV:リトナビル、TDF:テノホビルジソプロキシルフマル酸塩
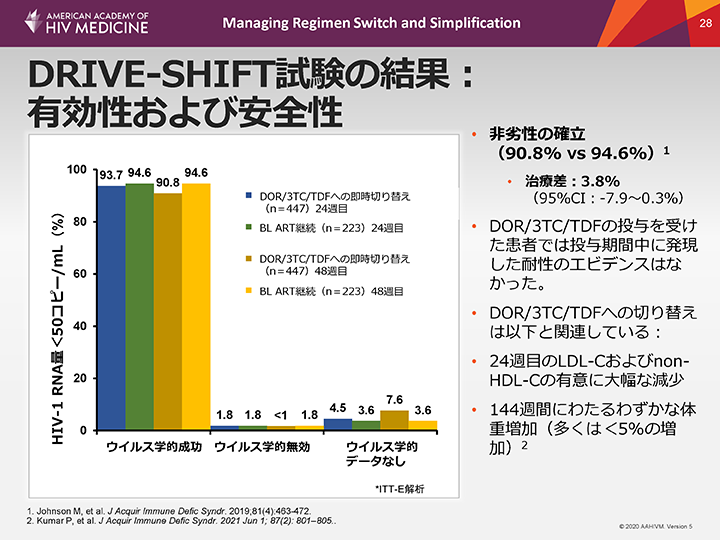
DRIVE-SHIFT試験の結果:有効性および安全性
リトナビル(rtv)を併用するPI、NNRTIまたはEVG/cベースのレジメンで安定したウイルス学的抑制が得られている成人患者において、DOR/3TC/TDFへの切り替えは、ベースラインARTの継続と比較して、24週目および48週目のウイルス学的抑制が非劣性であることが示された。24週目の治療差は-0.9% (95%CI:-4.7~3.0%)、48週目は-3.8%(95%CI:-7.9~0.3%)であった。DOR/3TC/TDFの投与を受けた患者において、投与期間中に発現した耐性のエビデンスはなかった。
試験への組み入れ時点でrtv併用のPIベースのARTの投与を受けていた患者については、DOR/3TC/TDFへの切り替えは、ベースラインARTの継続よりも24週時目のLDL-C(-16.5 vs -1.9 mg/dL) とnon–HDL-C (-24.7 vs -1.3 mg/dL) の有意な減少に関連した(それぞれP<0.0001)。
治験責任医師は、第III相DRIVE-SHIFT試験の144週までの体重変化の事後解析を実施した。144週間にわたる体重増加はわずかであった(DOR/3TC/TDFへ切り替え後の6ヵ月目および12ヵ月目の変化量の平均値は1 kg未満、DOR/3TC/TDFの投与を2年超にわたり受けた患者では1.2~1.4 kg)。試験に組み入れられた患者の10%未満に著しい(10%以上)体重増加がみられた。体重増加には人種、性別、民族による有意差はみられなかった。
3TC:ラミブジン、ART:抗レトロウイルス療法、BL:ベースライン、CI:信頼区間、DOR:ドラビリン、LDL-C:低比重リポタンパクコレステロール(LDLコレステロール)、non-HDL-C:非高比重リポタンパクコレステロール、TDF:テノホビルジソプロキシルフマル酸塩
380-1878試験:リトナビルを併用するPIベースのARTによりウイルス学的抑制が得られている患者におけるBIC/FTC/TAFへの切り替え
この第III相試験において、治験責任医師は、ウイルス学的抑制が得られている成人HIV感染患者577例(女性17%、黒人26%、年齢の中央値48歳)を組み入れ、ビクテグラビル(BIC) 50 mg/エムトリシタビン(FTC) 200 mg/テノホビルアラフェナミドフマル酸塩(TAF)25 mg投与群(n=290)、またはリトナビル(rtv)を併用するプロテアーゼ阻害剤(PI)ベースのレジメン継続群(n=287)に割り付けた。ベースラインでは、すべての患者がrtvを併用するPIベースのレジメンの投与を受けていた。また、ほとんどの患者がFTC/テノホビルジソプロキシルフマル酸塩(TDF)の投与を受けていた。この試験の主要評価項目は、48週目にウイルス学的抑制が得られていない(HIV-1 RNA量50コピー/mL以上) 患者の割合とした。
48週目の両群のウイルス学的抑制が得られていない患者の割合は同様であり(1.7% vs 1.7%、P=1.0)、事前に規定した非劣性の基準を満たした。さらに、HIV-1 RNA量が50コピー/mL未満であったのは、BIC群92.1%に対し、ベースラインART継続群では88.9%であった。
同様の試験である380-1844試験では、BIC/FTC/TAFへの切り替えは、DTG/ABC/3TCの投与継続に対して非劣性であることが示された。この多施設共同二重盲検無作為化実薬対照第III相試験では、DTG、ABCおよび3TCを含むレジメンの投与を受け、HIV-1 RNA量が50コピー/mL未満が3ヵ月以上持続し、eGFR (Cockcroft-Gault式)が50 mL/分以上、B型肝炎ウイルス感染による活動性肝炎が認められず、治験薬に対する耐性が確認されていないウイルス学的抑制が得られている成人患者563例を、BIC/FTC/TAFへの切り替えか、DTG+ABC/3TCレジメン継続群に無作為(1:1)に割り付けた。主要評価項目は、48週目のHIV-1 RNA量が50コピー/mL以上の患者の割合とした。
48週目にHIV-1 RNA量が50コピー/mL以上の患者の割合は、BIC/FTC/TAF群で1.1%、DTGおよびABC/3TC群で0.4%であった(差0.7%、95%CI:-1.0~2.8%)。HIV-1 RNA量が50コピー/mL未満の患者の割合は、BIC/FTC/TAF群93.6%に対し、DTGおよび3TC/ABC群では95.0%であった(p=0.59)。
3TC:ラミブジン、ABC:アバカビル、ART:抗レトロウイルス療法、ATV:アタザナビル、BIC:ビクテグラビル、DRV:ダルナビル、eGFR:推算糸球体濾過率、FTC:エムトリシタビン、TAF:テノホビルアラフェナミドフマル酸塩、TDF:テノホビルジソプロキシルフマル酸塩
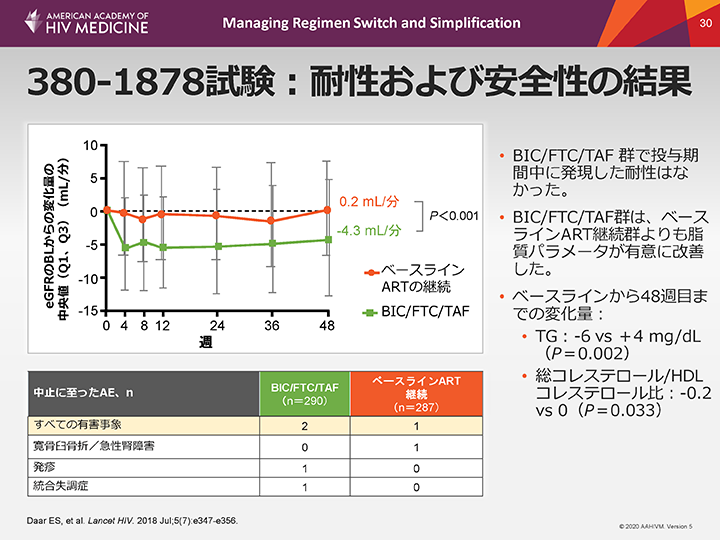
380-1878試験:耐性および安全性の結果
380-1878試験のBIC群では耐性発現が認められた患者はいなかったが、ダルナビル(DRV)+アバカビル(ABC)/3TCの投与を受けた患者1例に薬剤耐性関連変異が認められた。
重篤な有害事象の発現は両レジメンともに同程度であり、grade 3または4の有害事象の発現率はBIC群で4%、rtv併用のPI群で6%であった。BIC群では、腎合併症または尿細管障害のために試験を中止した患者はいなかった。
同様に、380-1844試験では、いずれの群においても投与期間中に発現した耐性はなかった。BIC/FTC/TAFの忍容性は良好であり、48週目における有害事象の発現は両群ともに同程度であった。
BIC/FTC/TAFに切り替えた場合の脂質、骨および腎臓に関する安全性プロファイルは、DTGおよびABC/3TCの投与を48週間継続した場合と同様であった。
380-1878試験とウイルス学的抑制が得られている治療歴のある成人患者におけるBIC/FTC/TAFへの切り替えを評価した他の3つの試験(380-1844試験、380-4030試験および380-4449試験)のプール解析では、65歳以上の患者において同様の結果が示された。投与期間中に発現した耐性、ウイルス学的失敗、grade 3および4の薬剤関連有害事象はみられず、脂質プロファイルにおけるわずかな改善が認められ、体重増加の中央値は1 kgであった。
AE:有害事象、ART:抗レトロウイルス療法、BIC:ビクテグラビル、BL:ベースライン、eGFR:推算糸球体濾過率、FTC:エムトリシタビン、HDL:高比重リポタンパク、TAF:テノホビルアラフェナミドフマル酸塩、TG:トリグリセリド
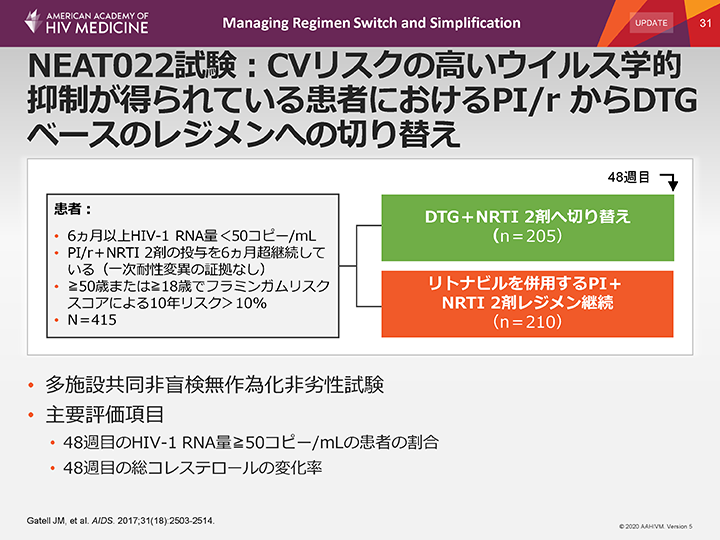
NEAT022試験:CVリスクの高いウイルス学的抑制が得られている患者におけるPI/r からDTGベースのレジメンへの切り替え
NEAT-002試験は、欧州6ヵ国で実施された非盲検無作為化試験であり、心血管リスクの高いウイルス学的抑制が得られているHIV感染患者415例が組み入れられ、ドルテグラビル(DTG)+NRTI 2剤(n=205)に切り替える群と、rtvを併用するPI+NRTI 2剤のレジメンを継続する群(n=210)に無作為に割り付けられた。年齢が50歳超、またはフラミンガムリスクスコアによる10年リスクが10%超の場合を高心血管リスクと定義した。
この試験は、DTGへの切り替えの非劣性を検証するためにデザインされた。2つの主要評価項目は、1)48週目まで治療反応(治験薬の投与を中止することなくHIV-RNA量50コピー/mL未満)を維持できた患者の割合、2)48週目の総コレステロール(TC)のベースラインからの変化率とした。無効は以下のいずれかと定義した:
- •ウイルス学的失敗、あらゆる原因による死亡、追跡不能、同意の撤回または何らかの理由による無作為に割り付けられた治療の永久的な変更もしくは中断。
CV:心血管、DTG:ドルテグラビル、PI/r:リトナビル(rtv)を併用するプロテアーゼ阻害剤
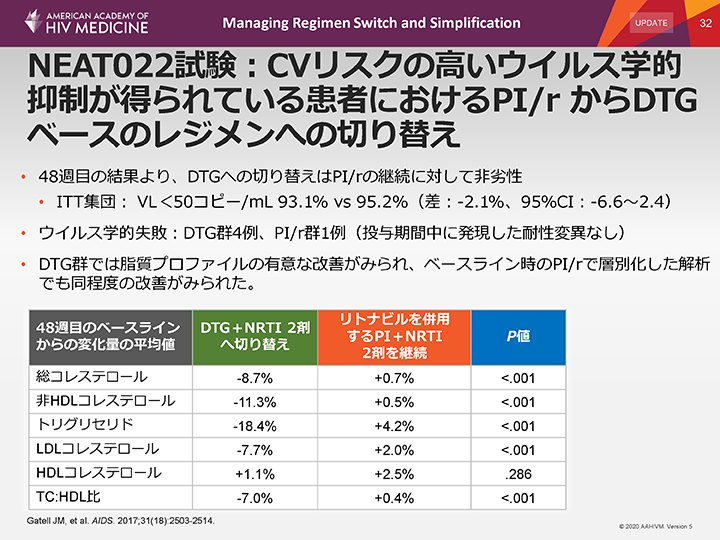
NEAT022試験:CVリスクの高いウイルス学的抑制が得られている患者におけるPI/r からDTGベースのレジメンへの切り替え
全体として、心血管疾患リスクの高いウイルス学的抑制が得られているHIV感染患者において、DTGベースのレジメンへの切り替えはrtv併用PIベースレジメンの継続に対して非劣性であることが示された。治療成功の維持は、DTGへ切り替えた患者の93.1%、rtv併用PIレジメン継続患者の95.2%であった(ITT集団、差:-2.1%)。ウイルス学的失敗はDTG群の4例に認められたのに対し、PI/r群では1例であり、いずれの群にも投与期間中に発現した耐性変異は認められなかった。
DTGへの切り替えにより、TCおよびその他の脂質パラメータ(HDLコレステロールを除く)の有意な改善がみられた(P<0.001)。両群間で、重度のgrade 3または4、あるいは治療変更に至る有害事象の発現率に有意差は認められなかった。
CV:心血管、DTG:ドルテグラビル、ITT:Intent-To-Treat、PI/r:リトナビル(rtv)を併用するプロテアーゼ阻害剤、TC:総コレステロール、VL:ウイルス量