抗HIV薬に対する耐性 Antiretroviral
Resistance
薬剤耐性検査
先進国の専門家委員会は耐性試験の指針に一貫性がある
先進国の複数の専門家委員会が、薬剤耐性検査の最適な実施に関する推奨を示している1-5。
薬剤耐性検査は、治療待機中に薬剤耐性株が減少し、野生型HIVの増殖がみられるため、薬剤耐性検査の感度が時間とともに低下することから、近い将来にARTが予定されているか否かにかかわらず、患者が臨床ケアを受け始めた際に実施すべきである。
コスト面や混合感染の検出感度が改善されたことから、初期HIV感染の状況においては薬剤耐性の遺伝子型検査を実施するよう推奨している。
- •US DHHSガイドライン1は、ARV未経験患者に対する標準的な薬剤耐性遺伝子型検査に、逆転写酵素(RT)およびプロテアーゼ(PR)の遺伝子変異の検査を含めるよう推奨している。
- •インテグラーゼ阻害薬(INSTI)に対する伝播性薬剤耐性が懸念される場合、医療提供者は薬剤耐性遺伝子型検査にINSTI耐性を調べる遺伝子型検査を必ず含めなければならない。エルビテグラビルおよびラルテグラビルに対する伝播性薬剤耐性の割合は非常に低く、ドルテグラビルおよびビクテグラビルに対する伝播性薬剤耐性はまれである10-13。
- •IAS-USAガイドライン2は、NRTIおよびNNRTIに対する伝播性薬剤耐性を評価するためにベースライン時の遺伝子型検査を推奨している。INSTI耐性を有するパートナーからの感染が疑われる場合を除き、ベースライン時のINSTI耐性を調べる遺伝子型検査は推奨していない。
- •BHIVAガイドラインは、ART開始前にRTおよびPR遺伝子の遺伝子型検査を実施するよう推奨している。INSTI耐性検査は、ベースライン時に他の伝播性薬剤耐性関連変異が認められる場合、または患者のパートナーにINSTI耐性の証拠が認められる場合にのみ推奨している3。
- •EACSガイドラインには、ベースライン時のINSTI耐性検査に関する推奨事項は明記されていない4。
未治療の妊婦と小児患者に対しても、薬剤耐性検査を推奨している。
いずれのパネルも、治療失敗時に薬剤耐性検査を実施するよう推奨している。
- •いくつかの無作為化試験で、この戦略(遺伝子型検査か表現型検査が用いられたかにかかわらず)がより良好なウイルス学的反応につながることが実証されている7-9。
- •治療失敗の場合は、遺伝子型または表現型検査のいずれかを実施することが望ましい。
- •複雑な治療歴のある患者に対しては、薬剤耐性の遺伝子型検査と表現型検査両方の実施が役立つ可能性がある。
- •理想的には、患者が失敗しているレジメンを継続している間に薬剤耐性検査を実施した方が良い。薬剤による選択圧が取り除かれると、薬剤耐性ウイルスが急速に野生型HIVに置き換わり、血漿中を循環する主要なHIV株となる。
世界保健機構(WHO)は、資源が限られた状況での薬剤耐性検査の実施はコストの問題を伴い、複雑であることを認識している。管理に関する意思決定の指針となる費用対効果の高い手段として、全国的な薬剤耐性率調査の実施が推奨されている6。
- •ARVの曝露歴にかかわらず、ARTを初回治療として開始する患者のNNRTIに対する治療前薬剤耐性の割合が10%以上の国では、NNRTIを含まない初回治療の代替ARTレジメンを考慮すべきである(WHOが2019年に更新した初回治療としてのARTレジメンおよび治療変更に関する推奨に規定されている)。
現時点では、抗CD4抗体である接着後阻害薬(post attachment inhibitor)であるibalizumabに対して利用可能な市販の薬剤耐性検査キットはない1。
BHIVA:英国HIV協会、DHHS:米国保健福祉省、EACS:欧州エイズ臨床学会、IAS-USA:国際エイズ学会-米国、WHO:世界保健機構
参考文献
- Saag MS, Gahdhi RT, Hoy Jf et al. Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2018 Recommendations of the International Antiviral Society-USA Panel. JAMA. 2020;324(16):1651-1669.
- British HIV Association guidelines for the routine investigation and monitoring of adult HIV-1-infected individuals (2019 interim update). Available at: https://www.bhiva.org/file/DqZbRxfzlYtLg/Monitoring-Guidelines.pdf. Accessed May 10, 2021.
- European AIDS Clinical Society. EACS Guidelines, version 10.1. October 2020. Available at: https://www.eacsociety.org/guidelines/eacs-guidelines/eacs-guidelines.html. Accessed May 10, 2021.
- Panel on Antiretroviral Therapy and Medical Management of Children Living with HIV. Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection. Available at https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/PedARV_GL.pdf. Accessed May 10, 2021.
- World Health Organization. Guidelines on the public health response to pretreatment HIV drug resistance, July 2017. Geneva: World Health Organization; 2017. License: CC BY-NC-SA 3.0 IGO. Available at: https://www.who.int/hiv/pub/guidelines/hivdr-guidelines-2017/en/. Accessed May 10, 2021.
- Durant J, Clevenbergh P, Halfon P, et al. Drug-resistance genotyping in HIV-1 therapy: The VIRADAPT randomised controlled trial. Lancet. 1999;353:2195-2199.
- Baxter JD, Mayers DL, Wentworth DN, et al. A randomized study of antiretroviral management based on plasma genotypic antiretroviral resistance testing in patients failing therapy. AIDS. 2000;14:F83-F93.
- Cohen CJ, Hunt S, Sension M, et al. A randomized trial assessing the impact of phenotypic resistance testing on antiretroviral therapy. AIDS. 2002;16:579-588.
- Young , Fransen S, Greenberg KS, et al. Transmission of integrase strand-transfer inhibitor multidrug-resistant HIV-1: case report and response to raltegravir-containing antiretroviral therapy. Antivir Ther. 2011;16:253-625.
- McGee KS, Okeke NL, Hurt CB, et al. Canary in the Coal Mine? Transmitted Mutations Conferring Resistance to All Integrase Strand Transfer Inhibitors in a Treatment-Naïve Patient. Open Forum Infect Dis. 2018; 5(11):ofy294.
- Mazzuti L, Melengu T, Falasca F, et al. Transmitted drug resistance mutations and trends of HIV-1 subtypes in treatment-naïve patients: A single-centre experience. J Glob Antimicrob Resist. 2020;20:298-303.
- Alvarez M, Casas P, de Salazar A, et al. Surveillance of transmitted drug resistance to integrase inhibitors in Spain: Implications for clinical practice. J Antimicrob Chemother. 2019;74(6):1693-1700.
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents Living with HIV. Department of Health and Human Services. June 3, 2021. Available at https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/AdultandAdolescentGL.pdf.Accessed August 2, 2021.
薬剤耐性の遺伝子型検査はHIV突然変異の解釈に依存
薬剤耐性遺伝子型検査では、患者から分離した主要なHIV株を用いてARV耐性との関連が示されている特定の遺伝子変異を検出する。薬剤耐性遺伝子型検査を行う際には、ポリメラーゼ連鎖反応(PCR)法を用いて逆転写酵素およびプロテアーゼ領域を増幅する。現在、多くの検査室では、要望があればインテグラーゼ領域も増幅することができる。
耐性に関連していることが判明している位置のアミノ酸変異について報告する。
Genotypic interpretation system(GIS)を用いてHIVの突然変異のパターンを解釈することができる1。
- •これらのパターンは、初回レジメン失敗後では比較的単純で予測可能な場合があるが、その後のレジメン失敗後では非常に複雑になる場合がある。
- •GISはコンピュータアルゴリズムと統計モデルを用いて変異のパターンを解釈し、ARVに対する感受性を予測する。
最もよく用いられるGISによる解析結果は比較的単純であるが、最適なサルベージ治療のレジメンを決定するにあたり、熟練した専門医のアドバイスが依然として重要な役割を果たしている。Havana試験では、担当医のみの薬剤耐性遺伝子型検査結果の解釈よりも、熟練した専門医のアドバイスを追加した方が有益であることを明らかにした2。
- •要因デザインを用いて、研究者らはウイルス学的失敗が認められた患者を、サルベージ治療のレジメンを選択する前に薬剤耐性遺伝子型検査と熟練した専門医のアドバイスを受ける群、またはいずれか一方のみを受ける群に無作為に割り付けた。この試験では、薬剤耐性検査の結果と熟練した専門医のアドバイス両方に基づいて選択したサルベージ治療のレジメンの方がウイルス学的治療アウトカムを改善することが示され、これらの併用はいずれか単独よりも優れていた。
現在の技術では、シーケンシングデータの検査室間の再現性は高い3。しかし、低ウイルス量(すなわち、200~1,000コピー/mL)の場合は薬剤耐性遺伝子型検査を実施する検査室の能力には多少のばらつきがある。
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
- Tural C, Ruiz L, Holtzer C, et al. Clinical utility of HIV-1 genotyping and expert advice: The Havana trial. AIDS. 2002;16:209-218.
- Shafer RW, Hertogs K, Zolopa AR, et al. High degree of interlaboratory reproducibility of Human Immunodeficiency Virus type 1 protease and reverse transcriptase sequencing of plasma samples from heavily treated patients. J Clin Microbiology. 2001; 39:1522-1529.
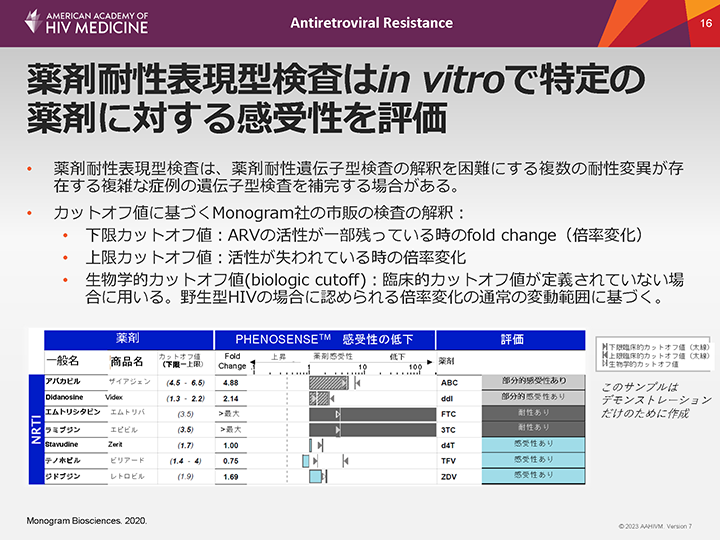
薬剤耐性表現型検査はin vitroで特定の薬剤に対する感受性を評価
薬剤耐性表現型検査は、in vitroで特定の薬剤に対する感受性を評価するものであり、変異の相互作用によりアウトカムの予測が困難になる場合がある複数の薬剤耐性変異(特にプロテアーゼの薬剤耐性変異)が存在する複雑な症例の遺伝子型検査を補完できる場合がある。
薬剤耐性表現型検査は、Monogram Biosciences社が販売する市販の検査として実施可能である1。
- •まず、PCR法を用いて、患者から分離したHIVの逆転写酵素(RT)およびプロテアーゼ(PR)(要望があればインテグラーゼ)領域の塩基配列を増幅する。次に、この配列をHIVの実験室株(RTとPR領域の塩基配列を欠失させた)に導入する。その後、キメラウイルスをCD4+T細胞株とともにさまざまな濃度の薬剤存在下で培養する。レポーター遺伝子(ルシフェラーゼ)は細胞が感染していることを示す。
- •各薬剤について、患者由来のキメラウイルスのIC50(HIVの増殖を50%抑制するのに必要な薬物濃度)を野生型HIVのIC50で除した比によって決定される倍率変化(FC)を求める。
表現型検査の結果は、各薬剤について定義されている臨床的カットオフ値に基づいて解釈する。各薬剤について2つの重要なカットオフ値がある。
- •下限カットオフ値は、感受性が低下し始めているが、依然として薬剤の活性が一部残っている場合のFCと定義される。
- •上限カットオフ値は、薬剤活性が完全に失われた時のFCである。
- •特定の薬剤についてこれらの臨床的カットオフ値が定義されていない場合、臨床医は、野生型HIVの場合に認められるFCの通常の変動範囲に基づく生物学的カットオフ値(biological cutoff)を用いることができる。
- •FCが上限カットオフ値を超える場合は、感受性の低下として報告する。しかし、FCが下限カットオフ値を下回る場合は、感受性の増強として報告する。
Monogram社のPhenoSenseアッセイにおいて、ウイルスのin vivoでの適応度の代替指標を提供する試みとして複製能(RC)も報告されている。
- •この方法で測定したRCの低下は、未治療患者における疾患進行の遅延と関連づけられている2。
- •しかし、現時点では、RCは患者の臨床管理において比較的限定的な役割しか果たしていない。
参考文献
- Monogram Biosciences. Phenosense HIV drug resistance assay. Available at: https://www.monogrambio.com/resources/phenotyping/phenosense. Accessed May 10, 2021.
- Goetz M, Leduc R, Kostman J, et al. HIV replicative capacity is an independent predictor of disease progression in persons with untreated chronic HIV infection. J Acquir Immune Defic Syndr. 2010;53:472-479.
ウイルス学的失敗が認められた患者の管理には薬剤耐性検査と患者の治療歴を含める
ウイルス抑制効果が不十分なレジメン下でHIVが複製された時、特定の薬剤で選択されたHIVの変異がその薬剤だけでなく、同じクラスの他の薬剤に対しても耐性を付与する場合がある。これは交差耐性と呼ばれている。
この現象は、NRTI、NNRTI、PIおよびINSTIで認められている。
交差耐性が発現する割合と交差耐性がそのクラスの他の薬剤に影響を及ぼす程度は、ARVによって異なる。
- •第1世代のNNRTIとINSTIには、高度の交差耐性がある。
- •NRTIに交差耐性が生じる可能性は異なるが、ラミブジンとエムトリシタビンには完全な交差耐性がある。
- •PIと第2世代のNNRTIでは、ウイルス学的失敗の間にそのクラスの薬剤に対する多くの薬剤耐性変異が蓄積するため、交差耐性の程度が高くなる。
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
血漿中HIV-1 RNA量が低値の場合、HIV-1プロウイルスDNAの検査で追加情報が得られることがある
血漿中HIV-1 RNA量が低値、またはPCR法による増幅が不可能な場合、HIV-1プロウイルス DNAの検査で追加情報が得られる可能性がある。
HIV-1プロウイルス DNAの検査はウイルス量>500コピー/mLの患者においても有用な場合がある。ウイルス量>500コピー/mLの患者89例で、HIV-1プロウイルスDNAの検査は、血漿中HIV-1 RNAの検査よりも薬剤耐性変異を高頻度に同定した。
参考文献
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents Living with HIV. Department of Health and Human Services. June 3, 2021. Available at https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/AdultandAdolescentGL.pdf. Accessed August 2, 2021.
- Saag MS, Gahdhi RT, Hoy Jf et al. Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2018 Recommendations of the International Antiviral Society-USA Panel. JAMA. 2020;324(16):1651-1669.
- Curanovic D, Martens S, Rodriguez M, et al. HIV-1 DNA Testing in Viremic Patients Demonstrates a Greater Ability to Detect Drug Resistance Compared to Plasma Virus Testing. Program and abstracts of the 23rd International AIDS Conference. July 6-10, 2020. Virtual. Abstract PDB0402.