抗HIV薬に対する耐性 Antiretroviral
Resistance
薬剤耐性と交差耐性の機序
▶︎NRTI耐性およびNNRTI耐性の機序、耐性関連変異、交差耐性
NRTI耐性は停止されたウイルスDNA鎖が伸長を再開できることによって生じる
逆転写では、正反応と逆反応間に平衡が存在する。
正反応の特徴は、プライマーの3‘-ヒドロキシ基が、次に入ってくるデオキシヌクレオシド三リン酸(dNTP)のαリン酸基に求核攻撃を行い、ホスホジエステル結合を形成し、ピロリン酸を放出することである。これにより、プライマー鎖の長さが1塩基分伸長する。この過程は、プライマーの伸長が自然に停止するまで、あるいは次に入ってくるdNTPが核酸アナログ(NRTI)になるまで続く。NRTIは、3’-ヒドロキシ基を欠くため、DNA鎖の伸長を早期停止させる。
逆反応では、遊離のピロリン酸またはアデノシン三リン酸(ATP)との結合により末端のヌクレオシド一リン酸がプライマーから切除される。これはpyrophosphorolysisと呼ばれている。末端の塩基がNRTIの場合、伸長が停止したプライマーからNRTIが切除されDNA鎖伸長の停止が解除され伸長が続行する。これはprimer unblocking(プライマー伸長の停止解除)と呼ばれている。
通常、NRTI耐性関連変異は、プライマー伸長の停止解除を促進するか、天然のdNTPよりも核酸アナログの取り込みを減少させることによって耐性を引き起こす。
- •TAMのM41L、D67N、K70R、L210W、T215Y/FおよびK219Q/E/Nはプライマー伸長の停止解除を促進する。TAMの数の増加は、プライマー伸長の停止解除の程度を比例的に増加させる。コドン69の挿入変異も、特にTAMの存在下ではプライマー伸長の停止解除を促進する。
- •M184V、Y115F、Q151M、L74V、V118IおよびK65R変異が耐性を引き起こす主な機序は、核酸アナログの取り込みに対するアロステリック干渉である。
参考文献
- Das K, Arnold E. HIV-1 reverse transcriptase and antiviral drug resistance. Part 2. Curr Opin Virol. 2013;3:119-128.
NRTI耐性関連変異にはいくつかのパターンがある
Thymidine analogue mutations(TAM:チミジンアナログ変異))-最もよくみられる
ジドブジンおよびサニルブジン(stavudine)で逆転写酵素の41、67、70、210、215および219番目のアミノ酸変異が選択される。TAMの数が増加するとin vivoにおいてすべてのNRTIの活性が低下する。
TAMには、通常2つの異なる進化の経路を示すクラスターが存在する。
- •最もよくみられる1つ目の経路にはM41L、L210WおよびT215Yが含まれる。
- •2つ目の経路にはD67N、K70R、T215FおよびK219Q/E/Nが含まれる。2つ目の経路では、1つ目の経路よりも他のNRTIとの交差耐性(表現型)が少ない。
Q151M複合変異
Q151Mは、チミジンアナログ/ジダノシンを含む併用レジメン投与患者の5~10%に発現し、すべてのNRTIに対して中等度耐性を付与する。Q151M変異は、通常、A62V、V75I/F、F77LおよびF116Y変異を伴う。
これらの変異はいずれも、Q151M変異を持つ分離株の薬剤耐性の程度と適応度を大幅に増加させる。
テノホビルはQ151M複合変異を持つHIVに対してある程度の活性を保持し、また、ラミブジンも活性を保持している可能性がある。
69挿入変異
コドン67~70の間のFingers領域への挿入、最もよくみられるのはコドン69への2つのアミノ酸の挿入で、複数のNRTI投与患者の1~2%に発現する。
コドン69の挿入変異は、通常、TAMを有するHIV株で認められる。
コドン69の挿入変異およびTAMを有する分離株は、現在利用可能なすべてのNRTIに対して高度な交差耐性を示す。
K65R変異
K65Rはテノホビルで選択され、また、程度は低いがアバカビルおよびジダノシンでも選択される。
K65Rはジダノシン、アバカビル、テノホビル、ラミブジン、エムトリシタビンおよびサニルブジンに対する感受性の低下をもたらす。K65Rはin vitroでジドブジンに対する感受性を高めるが、この知見の臨床的意義は明らかになっていない。
L74V変異
L74Vは、ジダノシン単剤療法患者に最もよくみられる変異であるが、アバカビル単剤療法患者にもみられる。
L74Vは、チミジンアナログとジダノシンまたはアバカビルを含む併用レジメンで選択されることはまれであるが、ジダノシン/ラミブジンまたはアバカビル/ラミブジンを含む併用レジメンで発現することがある。
L74Vはジダノシン、ラミブジン、エムトリシタビンおよびアバカビルに対して耐性または感受性の低下を付与する。
M184VやK65Rと同様、L74Vもジドブジンに対するTAM関連耐性の程度を低下させる。
M184V/I変異
ラミブジンとエムトリシタビンで、M184 V/I変異が選択される。
最初にM184Iが発現し、通常、その後に高い適応度に関連するM184V変異に置き換わる。
M184V/Iはアバカビルやジダノシンでも選択され、これらの薬剤に対してある程度の交差耐性を付与するが、この変異のみでこれらの薬剤に対する反応が大幅に低下することはない。
M184V/Iの発現は、ジドブジン、サニルブジンおよびテノホビルに対するTAM関連耐性の発現を遅延または防ぐ。この現象は、TAMや他の変異の蓄積によってみられなくなる可能性がある。
E44D/A変異およびV118I変異
E44D/AおよびV118I変異はいずれも未治療患者に発現するが、複数のNRTIへの曝露歴患者でも保有率が増加する。
E44DおよびV118I変異による逆転写酵素の変化は、TAM存在下におけるNRTI耐性の程度の増加において補助的な役割を果たしている可能性があるが、その臨床的意義は非常に限られている。
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
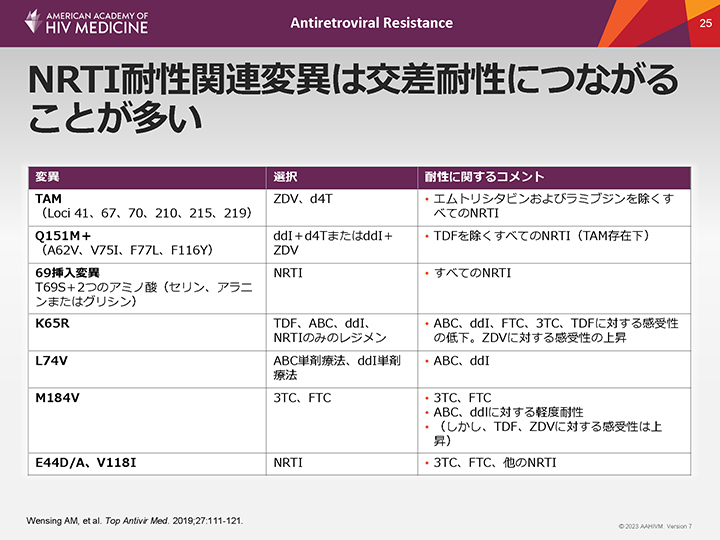
NRTI耐性関連変異は交差耐性につながることが多い
TAM
TAMの蓄積は、エムトリシタビンおよびラミブジンを除き、現在承認されているすべてのNRTIに対する感受性を低下させる1。交差耐性の程度は、特定の変異および関与する変異数に依存する。
Q151M複合変異
Q151M複合変異は通常、HIVがジダノシン+サニルブジンまたはジドブジンのいずれかの曝露後に発現する。その後、この変異の発現に伴い他に4つの変異(A62V、V75I、F77LおよびF116Y)が発現し、その結果、テノホビルを除くすべてのNRTIに対する感受性が失われる。
69挿入変異
コドン69の挿入変異はQ151M複合変異よりも頻度が低い。69挿入変異は必ずTAMやその他のいくつかの変異を背景として発現し、現在承認されているすべてのNRTIに対する耐性を付与する。
K65R変異
K65Rは、チミジンアナログ以外のNRTI(アバカビル、ジダノシン、エムトリシタビン、ラミブジンおよびテノホビルなど)に対する耐性を付与する。現在使用されているARTではほとんどみられないが、NRTIのみ(例えば、アバカビル/ラミブジン/テノホビル)のレジメンを処方され、チミジンアナログを処方されていなかった患者においてK65Rが高率に発現した。K65RはプライマーからのNRTIの切除を促進するTAMの作用に拮抗するため、レジメンにチミジンアナログを用いると、K65Rの発現リスクが低下するようである。注目すべきことに、BIC/FTC/TAFに切り替えた患者を対象とした最近の第III相試験では、K65R/Nを有する患者(7例)は全例、Week 48までウイルス学的抑制を維持した2。
L74VおよびM184V/I変異
L74VおよびM184V/I変異も交差耐性を引き起こすことがある。
- •L74V単独の場合、アバカビルおよびジダノシンに対する感受性が多少低下する。
- •M184Vはラミブジンおよびエムトリシタビンに対する耐性を引き起こし、アバカビルに対する感受性を低下させ、テノホビルおよびジドブジンに対する感受性を高める。
- •HIV RNA-1量50コピー/mL以下で、3TC+ブーストしたPIまたはINSTIのいずれかによる2剤併用療法に切り替え、少なくとも1つの薬剤耐性HIVの遺伝子型が認められる患者を対象とした後ろ向き観察研究では、87例にM184Vが認められ、349例には認められなかった。M184V変異を有する患者のうち、3年間ウイルス学的失敗が認められないと推定される患者の割合は87.8%(95%CI:78.4~97.2)で、M184V変異を有していない患者では91.9%(95%CI:86.6~97.2)であった(P=0.323)3。
E44D/AおよびV118I変異
これらの変異はラミブジンおよびエムトリシタビンに対して軽度耐性を引き起こし、おそらく他の各NRTIに対してもそれぞれに軽度耐性を引き起こす。E44DおよびV118I変異に関連する逆転写酵素の変化は、TAM存在下でのNRTIに対する耐性の程度の増加において補助的な役割を果たしている可能性があるが、その臨床的意義は非常に限られている。
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
- Andreatta K, Willkom, M, Martin R, et al. Switching to bictegravir/emtricitabine/tenofovir alafenamide maintained HIV-1 RNA suppression in participants with archived antiretroviral resistance including M184V/I. J Antimicrob Chemother. 2019;74(12): 3555–3564.
- Gagliardini R, Ciccullo A, Borghetti A, et al. Impact of the M184V Resistance Mutation on Virological Efficacy and Durability of Lamivudine-Based Dual Antiretroviral Regimens as Maintenance Therapy in Individuals With Suppressed HIV-1 RNA: A Cohort Study. Open Forum Infect Dis. 2018;5(6):ofy113.
NNRTI耐性関連変異はRTのNNRTI結合部位の形状を変化させる
逆転写の触媒ドメインは、しばしば右手に例えられる三次元構造を取る。
多様な化学構造を持つにもかかわらず、NNRTIはすべて、RTの活性ドメインと異なる部位であるHIV-1 RTの疎水性ポケット内部の同じような位置に結合する。NNRTIが結合するとRTの構造が変化し、これによりポリメラーゼ活性部位において触媒作用を示すアスパラギン酸残基の位置変更が引き起こされる。
NNRTI耐性関連変異のほぼすべてが、このNNRTI結合ポケットの内部または近傍で認められ、NNRTIポケットの形状を変化させてNNRTIが結合できないようにする。
第2世代のNNRTIであるエトラビリン、リルピビリンおよびドラビリンは、より柔軟な化学構造を有しており、変異があってもポケット内部で結合することができる。
参考文献
- Das K, Arnold E. HIV-1 reverse transcriptase and antiviral drug resistance. Part 2. Curr Opin Virol. 2013;3:119-128.
NNRTI耐性関連変異は交差耐性を媒介する
EFVとNVP間には、特にコドン103、181、188の変異に関して、交差耐性が多くみられる1。
ETRは、第1世代NNRTIに影響を及ぼすほとんどの主要な変異(Y181Cを除く)存在下でも活性を保持する2。
RPVによる治療の失敗は、K101E/P、E138A/G/K/Q/R、V179L、Y181C/I/V、Y188L、H221Y、F227CおよびM230I/L変異と関連している1,4。第III相臨床試験(ECHOおよびTHRIVE試験)において、RPVに対する耐性がみられた患者の90%にETRに対する交差耐性がみられた3。
最もよくみられるNNRTI RAMであるK101E、K103N、V106I、V108I、E138AおよびY181Cの存在下でも、DORに対する感受性が保持される7。DORによる治療の失敗は、EFV/ETV使用歴およびY188L変異と関連している6。感受性の低下はY188LまたはY318F(一塩基置換)と関連しているが、通常、DORに対する感受性を低下させるには5つ以上のNNRTI RAMが必要である7。
K103N変異
K103Nはエファビレンツによる治療が失敗した患者の50%以上で発現し、ネビラピンに対する高度耐性にもつながる。
しかし、K103Nはエトラビリンの抗ウイルス効果には影響を及ぼさず1,2、in vitroではリルピビリンやドラビリンに対する感受性に影響を及ぼさない1,5。
Y181C変異
Y181Cはネビラピンで選択されることが多く、エファビレンツに対しては極めて少ない程度の耐性しか付与しない。
- •しかし、ネビラピンを用いた後にエファビレンツを含むARTレジメンを用いる試みは、エファビレンツに対する耐性の急速な発現につながることが示されている。
Y181Cは、エトラビリンに対する感受性の低下および臨床効果の減弱と関連しており、他の変異と比較して、製造業者のエトラビリンに関するスコアリングシステムにおいて最も重要視されている変異の1つである1,2。
また、Y181Cはリルピビリンに対する感受性を2.5~3倍低下させ、リルピビリン投与患者においてよくみられる1。
一方、ドラビリンは、in vitroでY181Cを持つ変異株に対する活性を保持する1。
Y188C/L/HおよびG190A/S変異
逆転写酵素領域のコドン188と190の変異は、ネビラピンおよびエファビレンツに対する耐性を付与する。しかし、エトラビリンは、これら両方の変異の存在下において活性を保持する1。
Y188L変異はネビラピン、エファビレンツおよびドラビリンで選択されることが知られており、ドラビリンに対する感受性を10倍以上、リルピビリンに対する感受性を5~6倍低下させる1。Y188L置換単独、K103NまたはV106Iと共存するY188L置換、G190AおよびF227Lと共存するV106A、またはY181CおよびM230Lと共存するE138Kを含む臨床分離株では、ドラビリンに対する感受性が100倍超低下することが示された6。Y188Lは単独でDORに対する耐性を付与する場合があるが、通常、DORに対する感受性を低下させるためには少なくとも5つ以上のNNRTI RAMが必要である7。
一方、ドラビリンは、in vitroでG190Aのみを含む変異株に対して活性を保持する1。
E138K変異
E138Kは、リルピビリンで選択されることが多い変異である1,3,4。
E138Kはリルピビリン、エトラビリン、ネビラピンおよびエファビレンツに対する感受性を約2~5倍低下させる。NRTI耐性関連変異であるM184Iと共存すると、RPVに対する感受性が最大5倍低下し、RPVを含むレジメン下でウイルス学的失敗を引き起こすには十分であることが示されている5。
V106A/M変異
V106A変異は、NVP(感受性を50倍低下させる)およびDOR(感受性を10倍以上低下させる)で選択される1,5。前述したように、V106AがG190AやF227等の他のDOR耐性関連変異と共存すると、DORに対する高度耐性を引き起こす。
V106Mは主にEFVとNVPで選択され、感受性を30倍以上低下させる。V106MはDORでも選択され、予備データから、DORに対する感受性の低/中程度の低下に関連することが示唆されている。
DOR:ドラビリン、EFV:エファビレンツ、ETR:エトラビリン、NVP:ネビラピン、RPV:リルピビリン
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
- Vingerhoets J, Tambuyzer L, Azijn H, et al. Resistance profile of etravirine: Combined analysis of baseline genotypic and phenotypic data from the randomized, controlled phase III clinical studies. AIDS. 2010;24:503-514.
- Cohen CJ, Molina JM, Cahn P. Efficacy and safety of rilpivirine (TMC278) versus efavirenz at 48 weeks in treatment-naïve, HIV-1-infected patients: Pooled results from the phase III double-blind, randomized ECHO and THRIVE trials. J Acquir Immune Defic Syndr. 2012;60:33-42.
- Molina JM, Cahn P, Grinsztejn, et al. Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatment-naïve adults infected with HIV-1 (ECHO): A phase III randomised double-blind active-controlled trial. Lancet. 2011;378:238-246.
- Stanford University HIV Drug Resistance Database. Available at: https://hivdb.stanford.edu. Accessed July 14, 2020.
- Sterrantino G, Borghi V, Callegaro AP, et al. Prevalence of predicted resistance to doravirine in HIV-1 positive patients after exposure to non-nucleoside reverse transcriptase inhibitors. Int J Antimicrob Agents. 2019;53(4):515-519.
- Martin EA, Lai J, Ngo W, et al. Review of Doravirine Resistance Patterns Identified in Participants During Clinical Development. J Acquir Immune Defic Syndr. 2020;85(5):635-642.