抗HIV薬に対する耐性 Antiretroviral
Resistance
薬剤耐性と交差耐性の機序
▶︎PI耐性およびINSTI耐性の機序、耐性関連変異、交差耐性
PI耐性はプロテアーゼ結合部位内の変異によって引き起こされる
プロテアーゼは、ウイルスの成熟に必要なGagおよびGag/Polポリプロテイン前駆体を処理する。X線結晶構造解析を用いたプロテアーゼの可視化により、PIクラスの薬剤開発が可能となった。
プロテアーゼはホモ二量体として存在し、各サブユニットは99のアミノ酸から構成され、プロテアーゼの活性部位であるクレフトを形成する。PIは競合阻害薬として作用し、このクレフト内で結合して酵素活性を阻害する。
クレフト内でPIを除外するような変異が発現し、耐性が生じる。
ほとんどのPI耐性ウイルスは、プロテアーゼ内の耐性変異によって引き起こされる基質結合クレフトの変化を補うために、少なくとも1つのGag切断部位の変異を必要とする。
参考文献
- Miller V. International perspectives on antiretroviral resistance. Resistance to protease inhibitors. J Acquir Immune Defic Syndr. 2001;26 Suppl 1:S34-S50.
PI耐性関連変異は一次(主要)変異と二次(副次)変異に分類される
PI耐性関連変異は、通常、一次変異(1剤以上のプロテアーゼ阻害薬に対して高度耐性を付与する変異)と二次変異(一次変異が存在する場合、耐性の程度またはウイルスの適応度を高める変異)に分類される。
ほとんどの一次変異は、ある程度の交差耐性を引き起こす。
ある1つのプロテアーゼ阻害薬に対して高度耐性を引き起こし、交差耐性を引き起こさないいくつかのsignature変異が特定されている。
- •アタザナビル耐性を引き起こすI50L変異およびネルフィナビル耐性を引き起こすD30N変異は、このクラスの薬剤間での交差耐性を引き起こさないsignature変異の良い例である。
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
PIベースレジメン失敗後の耐性パターンは複雑である可能性
さまざまなPI(特にブースターを併用しないプロテアーゼ阻害薬)への曝露中に、いくつかのプロテアーゼ変異が発現する。
ある程度の交差耐性を引き起こすプロテアーゼの一次変異は、V32I、M46I/L、G48V/M、I50V、I54V/T/A/L/M、L76V、V82A/T/F/S、I84V、N88SおよびL90Mである1。
PI間の交差耐性は、多くのPI耐性関連変異が生じ、また、同じ位置の異なる変異がPIに対する感受性に及ぼす影響は大きく異なることがあるため、複雑になる場合がある。これは特にコドン50、54および82で生じた変異で認められる。
しかし、ダルナビルとtipranavirは従来のPIに耐性を示すウイルスに対して活性を保持していることが多く、多くの薬剤に耐性を有する患者で臨床的有用性が示されている。
- •臨床試験では、以下の変異のうち3つ以上を有する場合、ダルナビルに対する効果の減弱が認められている:V11I、V32I、L33F、I47V、I50V、I54L/M、T74P、L76V、I84VおよびL89V2
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
- De Meyer S, Dierynck I, Lathouwers E, et al. Identification of mutations predictive of a diminished response to darunavir/ritonavir: Analysis of data from treatment-experienced patients in POWER 1, 2, 3, and DUET-1 and DUET-2. Program and abstracts of the 6th European HIV Drug Resistance Workshop; March 26-28, 2008; Budapest, Hungary. Abstract 54.
- Talbot A, Grant P, Taylor J, et al. Predicting tipranavir and darunavir resistance using genotypic, phenotypic, and virtual phenotypic resistance patterns: An independent cohort analysis of clinical isolates highly resistant to all other protease inhibitors. Antimicrob Agents Chemother. 2010;54:2473-2479.
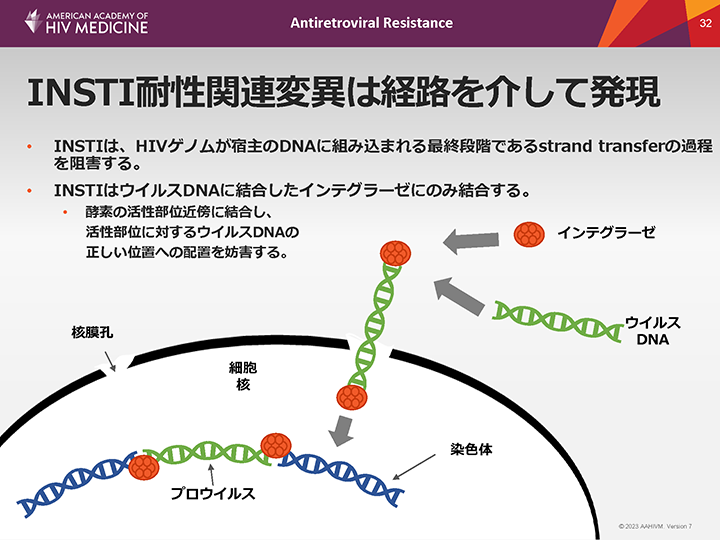
INSTI耐性関連変異は経路を介して発現
HIVインテグラーゼは、二本鎖HIV cDNAが宿主DNAに不可逆的に組み込まれるまでのいくつかの段階を触媒する。
INSTIは、プライミングされたウイルスDNA末端と切断された宿主DNAが共有結合する組み込みの最終段階(「strand transfer」)を阻害する。
INSTIはウイルスDNAに結合したインテグラーゼにのみ結合する。酵素の活性部位近傍に結合し、活性部位に対するウイルスDNAの正しい位置への配置を妨害し、インテグラーゼと活性部位にある極めて重要な2つのマグネシウムイオンの相互作用を阻害する。
INSTI耐性に関連する複数の変異が同定されているが、HIVインテグラーゼの全長の結晶構造はまだ解明されていない。
NNRTIと同様、第1世代INSTI間には交差耐性が多く生じる
第1世代のINSTIであるラルテグラビルとエルビテグラビル間には交差耐性が多く生じる。
ラルテグラビル耐性は3つの主要な変異獲得経路、時に重複した経路により生じる:
- •N155Hとそれに続くE92Qおよびその他の副次変異
- •Q148H/R/K+G140S/Aおよびその他の副次変異
- •Y143C/R+T97Aおよびその他の副次変異
Y143C/Rを除き、ほとんどのRAL耐性関連変異はエルビテグラビルに対する交差耐性を付与する。同様に、ほとんどのエルビテグラビル耐性関連変異は、ラルテグラビルに対する交差耐性を付与する可能性が高いようである。
参考文献
- Hatano H, Lampiris H, Fransen S, et al. Evolution of integrase resistance during failure of integrase inhibitor-based antiretroviral therapy. J Acquir Immune Defic Syndr. 2010;54:389-393.
INSTI耐性関連変異
N155H1,2,6
N155H変異は、ラルテグラビルによる治療の失敗の早期に発現するが、ラルテグラビル投与を継続するとこの変異を持つウイルスは、徐々にG140S+Q148H/R/K変異を有するより高度の耐性を示すウイルスに置き換わる1。
N155Hはラルテグラビルおよびエルビテグラビルに対する高度耐性と関連している。また、ベースライン時にN155Hを有し、さらなるINSTI耐性関連変異が発現した患者において、DTGを含むレジメンでウイルス学的失敗が報告されている6-8。
Q148H/R/K1,2,6
インテグラーゼのコドン148における変異は、ラルテグラビルベースのレジメンの失敗患者において、後で発現することが多い。
コドン140の変異を伴うコドン148の変異は、ラルテグラビルおよびエルビテグラビルに対する高度耐性を引き起こす。
一般的に、ラルテグラビル/エルビテグラビルに耐性を示す患者にドルテグラビル 50 mg BID投与した場合、良好な反応が認められる。しかし、コドン148の変異と2つ以上の副次変異(G140A/C/S、E138A/K/TまたはL74I)が共存する場合は、ドルテグラビルに対する反応が低下する3。
Q148H/K/R変異のみの場合は、DTGおよびBICに対する感受性に及ぼす影響は最小限である。しかし、Q148HとG140Sが共存する場合はビクテグラビルに対する感受性が4.8倍低下し、E138K(± G140S/A)ともう1つの変異(N155Hまたは副次変異であるL74Mと T97A)がQ148と共存する場合は、ビクテグラビルおよびドルテグラビルに対する感受性が10倍超低下することが示されている1,6。
Y143C/R1,2,6
ラルテグラビルを含むレジメンの失敗に伴うインテグラーゼのコドン143の変異の発現は、比較的まれである。
部位特異的変異導入実験では、コドン143の変異はエルビテグラビルに対する交差耐性をもたらさないことが示唆されているが、現在のところ、この変異を有する患者に対するエルビテグラビルの使用を支持する臨床データが不足している。Y143変異はDTGおよびBICに対する感受性を低下させないようである。
E92Q1,6
E92Qは、エルビテグラビル投与中のウイルス学的失敗時に発現する、最もよくみられるインテグラーゼ変異であり、エルビテグラビルに対する感受性を20倍以上低下させることが示されている。この変異がもたらすラルテグラビルに対する交差耐性は少なく(感受性の低下は5倍未満)、ドルテグラビルに対する感受性に及ぼす影響は最小限である(約1.5倍の低下)。ビクテグラビルに対する感受性は低下させないようである。
R263K1,6
R263Kはin vivoでドルテグラビルおよびラルテグラビル投与中に選択され、ビクテグラビル、ドルテグラビル、エルビテグラビルおよびラルテグラビルに対する感受性を2~5倍低下させる。R263Kは、DTGを含むウイルス抑制効果が不十分なレジメンを受けている間にウイルス学的失敗が認められた患者において高い割合で発現し、RALの投与患者にも認められることがある。
R263Kは、in vitroでエルビテグラビル、ビクテグラビルおよびカボテグラビルでも選択される。
G118R1,6
G118RはDTGの投与患者に発現するまれな変異である。この変異によりDTGに対する感受性が5倍低下し、BICに対する感受性が2~3倍低下する(RALおよびEVGに対する感受性も5~10倍低下する)。G118Rは、最近、DTG耐性に関連する主要な変異としてIAS-USA HIV Drug Resistance Mutations Listに追加された。
参考文献
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
- Hatano H, Lampiris H, Fransen S, et al. Evolution of integrase resistance during failure of integrase inhibitor-based antiretroviral therapy. J Acquir Immune Defic Syndr. 2010;54:389-393.
- Castagna A, Maggiolo F, Penco G, et al. Dolutegravir in antiretroviral-experienced patients with raltegravir- and/or elvitegravir-resistant HIV-1: 24-week results of the phase III VIKING-3 Study. J Infect Dis. 2014;210:354-362.
- Wijting I, Rokx C, Boucher C, et al. Dolutegravir as maintenance monotherapy for HIV (DOMONO): a phase 2, randomised non-inferiority trial. Lancet HIV. 2017;4(12):e547-e554.
- Blanco JL, Oldenbuettel C, Thomas R, et al. Pathways of resistance in subjects failing dolutegravir monotherapy. 2017 Conference on Retroviruses and Opportunistic Infections. February 13-16, 2017. Seattle, WA. Abstract 42.
- Stanford University HIV Drug Resistance Database. Available at: https://hivdb.stanford.edu. Accessed May 10, 2021.
- Carganico A, Dupke S, Ehret R, Berg T, Baumgarten A, Obermeier M, and Walter H. New dolutegravir resistance pattern identified in a patient failing antiretroviral therapy. J Int AIDS Soc. 2014;17(4 Suppl 3):19749.
- Hardy I, Brenner B, Quashie P, Thomas R, Petropoulos C, Huang W, Moisi D, Wainberg MA, and Roger M. Evolution of a novel pathway leading to dolutegravir resistance in a patient harbouring N155H and multiclass drug resistance. J Antimicrob Chemother. 2015;70(2):405-411.
第2世代INSTI
第2世代のINSTIであるドルテグラビル、ビクテグラビルおよびカボテグラビルは、ラルテグラビルおよびエルビテグラビルよりも耐性バリアが高い。
ドルテグラビル 50 mg BID投与した場合、ラルテグラビルおよびエルビテグラビル耐性を示すほとんどのウイルス株に対して十分な活性を示す1。さらに、アドヒアランスが低い患者において、ドルテグラビルとその他の活性のあるARV 2剤の併用レジメンを用いた場合、RAL、NNRTIおよびブーストしたPIなどの従来のARVよりも高いウイルス学的抑制が達成される14。
ビクテグラビルはこれまでTAF/エムトリシタビンとの配合剤としてのみ臨床研究が行われており、ドルテグラビル単剤による治療のウイルス学的失敗時に認められるような変異から保護されている可能性がある2。In vitroでは、BICは多剤耐性HIVを保有し、INSTIベースのレジメンに失敗した患者由来のほとんどの分離株に対して活性を保持していた1,3。
同様に、CABは他のINSTIによる治療が失敗した患者から分離されたHIV株に対しても活性を保持することが示されている4。
Q148H/K/Rは、単独のインテグラーゼ変異である場合はDTG、BICおよびCABに対する感受性に及ぼす影響は最小限である。しかし、Q148変異が1つ以上の副次変異と共存する場合はウイルス学的反応および/または感受性が大幅に低下する:
Q148変異+G140A/C/S、E138A/K/TまたはL74I(CABおよびDTGに対するウイルス学的反応の低下がみられる)5,6
Q148変異+L74I/M、E92Q、T97A、E138A/K、G140A/SまたはN155H(DTGに対する感受性が5~20倍低下し、ウイルス学的抑制率が低下。また、CABに対する感受性が50倍低下する)2,6
Q148変異+E138K±G140SA(DTGおよびBICに対する感受性が10倍低下し、CABに対する感受性が98倍低下する)
Q148変異+E138K±G140SA+1~2つのさらなる変異(N155H、L74M、T97Aなど)(DTGおよびBICに対する感受性が10倍超低下し、CABに対する感受性が100倍超低下する)5,7
Q148H+G140Sおよび多くの場合、少なくとも1つの他の置換変異(インテグラーゼのL74M、T97A、S119P/T、E138A/K、またはY143C/R/HとG163R)(BIC、DTGおよびCABに対する感受性が低下し、2つ以上の副次変異を伴う場合は高度耐性がみられる)1,3,5
現在、US DHHSおよびEACSのガイドラインでは、DTG/3TCは初回治療として推奨されるARTレジメンである8。2剤併用のDTGベースレジメンでは、薬剤耐性変異の発現は報告されていない。さらに、主要なRAMをarchived mutationsとして有する患者(4つの薬剤クラスのうちのいずれかに対する耐性関連変異を有し、特に3TC耐性関連変異を有する患者)では、DTG/3TCに切り替え後にウイルス学的抑制が維持された9,10,11。
BIC/FTC/TAFは、既存のNRTI耐性関連変異(M184V/Iなど)およびNNRTI耐性関連変異(archived resistance)を有する患者においても有効であることが示されている12,13。
参考文献
- Castagna A, Maggiolo F, Penco G, et al. Dolutegravir in antiretroviral-experienced patients with raltegravir- and/or elvitegravir-resistant HIV-1: 24-week results of the phase III VIKING-3 Study. J Infect Dis. 2014;210:354-362.
- Stanford University HIV Drug Resistance Database. Available at: https://hivdb.stanford.edu. Accessed May 10, 2020.
- Santoro MM, Fornabaio C, Malena M, et al. Susceptibility to HIV-1 integrase strand transfer inhibitors (INSTIs) in highly treatment-experienced patients who failed an INSTI-based regimen. Int J Antimicrob Agents. 2020;106027.
- Saladini F, Giannini A, Boccuto A, et al. Comparable In Vitro Activities of Second-Generation HIV-1 Integrase Strand Transfer Inhibitors (INSTIs) on HIV-1 Clinical Isolates with INSTI Resistance Mutations. Antimicrob Agents Chemother. 2019;64:e01717-19.
- Cheung PK, Shahid A, Dong, WK, et al. Evaluation of combinations of clinical integrase mutations on InSTI Resistance. Program and abstracts of the 2021 Conference on Retroviruses and Opportunistic Infections. March 6-10, 2021. Virtual. Abstract 432.
- Hatano H, Lampiris H, Fransen S, et al. Evolution of integrase resistance during failure of integrase inhibitor-based antiretroviral therapy. J Acquir Immune Defic Syndr. 2010;54:389-393.
- Wensing AM, Calvez V, Ceccherini-Silberstein F, et al. 2019 update of the drug resistance mutations in HIV-1. Top Antivir Med. 2019;27(3):111-121.
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV. Department of Health and Human Services. June 3, 2021. Available at https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/AdultandAdolescentGL.pdf. Accessed August 2, 2021.
- Wang R, Wright J, Khaled, et al. Assessing the virologic impact of archived resistance in an HIV-1 Switch Study TANGO Through Week 48. Program and abstracts of the 2020 Conference on Retroviruses and Opportunistic Infections. March 8-11, 2020. Boston, Massachusetts (Virtual). Abstract 489.
- de Miguel, Rial D, Dominguez-Dominguez L, et al. Long-term DTG+3TC switch efficacy in patients with archived 3TC resistance. Program and abstracts of the 2020 Conference on Retroviruses and Opportunistic Infections. March 8-11, 2020. Boston, Massachusetts (Virtual). Abstract 146.
- Deschanvres C, Raffi F, Reynes J, et al. Virologic failure and resistance in dolutegravir-based maintenance dual regimens. Program and abstracts of the 2020 Conference on Retroviruses and Opportunistic Infections. March 8-11, 2020. Boston, Massachusetts (Virtual). Abstract 490.
- Sax PE, Rockstroh JK, Luetkemeyer AF, et al. Switching to bictegravir, emtricitabine, and tenofovir alafenamide in virologically suppressed adults with HIV. Clin Infect Dis. 2020;ciaa988. [Online ahead of print]
- Acosta RK, Willkom M, Andreatta K, et al. Switching to Bictegravir/Emtricitabine/Tenofovir Alafenamide (B/F/TAF) From Dolutegravir (DTG)+F/TAF or DTG+F/Tenofovir Disoproxil Fumarate (TDF) in the Presence of Pre-existing NRTI Resistance. J Acquir Immune Defic Syndr. 2020;85(3):363-371.
- Parienti JJ, Fournier AL, Cotte L, et al. Forgiveness of Dolutegravir-Based Triple Therapy Compared With Older Antiretroviral Regimens: A Prospective Multicenter Cohort of Adherence Patterns and HIV-RNA Replication. Open Forum Infect Dis. 2021;8(7):ofab316.